อนุภาคในอะตอม
อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค ได้แก่
อนุภาคในอะตอม
อนุภาคขนาดเล็กคือโปรตอน, นิวตรอน และอิเล็กตรอน มีคุณสมบัติต่างกันดังตาราง
อนุภาค
|
สัญลักษณ์
|
ประจุ(คูลอมบ์)
|
น้ำหนัก(กิโลกรัม)
|
โปรตอน
|
p
|
+1.60x10-19
|
1.67x10-27
|
นิวตรอน
|
n
|
ไม่มีประจุ
|
1.67x10-27
|
อิเล็กตรอน
|
e-
|
-1.60x10-19
|
9.11x10-31
|
จากตาราง
จำนวนโปรตอน = จำนวนอิเล็กตรอน
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
เราสามารถเขียนเป็นสัญลักษณ์เพื่อระบุเลขอะตอมและเลขมวลได้ดังนี้
เมื่อ A แทน เลขมวล
Z แทน เลขอะตอม
X แทน สัญลักษณ์ของธาตุ
เช่น 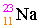
เลขอะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน
11 = จำนวนโปรตอน = จำนวนอิเล็กตรอน
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
23 = 11 + จำนวนนิวตรอน
จำนวนนิวตรอน = 23 - 11 = 12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน, อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
ไอโซโทป (isotope) หมายถึง อะตอมของธาตุชนิดเดียวกันที่มีเลขอะตอม (Z) เท่ากัน แต่เลขมวล (A) ไม่เท่ากัน ตัวอย่างเช่น อะตอมของไฮโดรเจนมีเลขมวลสามชนิดโดยแตกต่างกันที่จำนวนนิวตรอน ได้แก่
ไฮโดรเจน (Hydrogen) มี 1 โปรตอนและไม่มีนิวตรอน มีสัญลักษณ์ 11H
ดิวทีเรียม (Deuterium) มี 1 โปรตอนและมี 1 นิวตรอน มีสัญลักษณ์ 21H
ทริเทียม (Tritium) มี 1 โปรตอนและมี 2 นิวตรอน มีสัญลักษณ์ 31H
สมบัติทางเคมีของธาตุถูกก้าหนดโดยจำนวนโปรตอนและอิเล็กตรอนในอะตอม นิวตรอนไม่มีส่วนเกี่ยวข้องในการเปลี่ยนแปลงทางเคมีตามปกติ ดังนั้นไอโซโทปของธาตุเดียวกันจึงมีสมบัติทางเคมีเหมือนกันเกิดสารประกอบประเภทเดียวกันและมีความไวต่อปฏิกิริยาเคมีทำนอง
ไอโซโทน (isotone) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีจำนวนนิวตรอนเท่ากัน แต่จำนวนโปรตอน เลขอะตอมและเลขมวลไม่เท่ากัน เช่น 3919K 4020Ca มีนิวตรอนเท่ากัน คือ 20
ไอโซบาร์ (isobar) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากันแต่เลขอะตอมต่างกัน เช่น 146C 147N
ที่มา:mahidol เเละ boonmawong


ไม่มีความคิดเห็น:
แสดงความคิดเห็น